I tuoi occhi

Malattie oculari
Degenerazione maculare legata all’età (AMD o DMLE)
Cos’è?
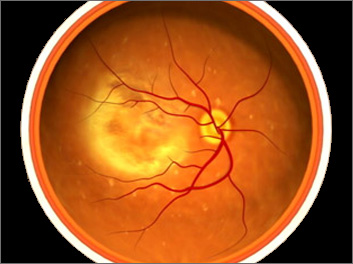

Cosa provoca?
È causa di un’importante e irreversibile riduzione della funzionalità visiva a livello del campo visivo centrale. Il fenomeno correlato più comune è il processo d’invecchiamento dell’occhio: la macula, contenente numerosi fotorecettori (vi sono concentrati i coni), si altera sino a perdere le sue caratteristiche. Ciò è dovuto alla morte delle cellule retiniche, che può essere lenta e progressiva oppure più rapida e drammatica.
Quant’è diffusa?
La degenerazione maculare legata all’età (AMD o DMLE) è attualmente considerata la prima causa di cecità centrale nei Paesi di maggior benessere e la terza in assoluto. Indicativamente il 5% della cecità mondiale è attribuibile all’AMD, una percentuale che sale però al 41% nei Paesi benestanti. Inoltre è un’importante causa d’ipovisione.


L’incidenza dell’AMD è rara prima dei 55 anni, ma aumenta soprattutto dopo i 75 anni. La forma più grave della malattia, detta “umida”, è meno frequente e a più rapida evoluzione ma attualmente è l’unica considerata trattabile.
Quali sono i suoi sintomi?
I sintomi iniziali della degenerazione maculare può essere una distorsione delle immagini nella parte centrale del campo visivo (dove si punta lo sguardo). Altri sintomi piuttosto comuni sono: diminuzione dell’acuità visiva, difficoltà nella lettura e nello svolgimento di attività a distanza ravvicinata (in cui è richiesta la visione dei piccoli dettagli), necessità di utilizzare una fonte di luce sempre più intensa per vedere da vicino, perdita della brillantezza dei colori, difficoltà a riconoscere i volti delle persone, difficoltà nell’adattamento al buio. La degenerazione maculare comporta dunque una severa penalizzazione visiva, ma è bene sottolineare che essa (anche nei casi più gravi), non provoca la cecità totale, in quanto la visione paracentrale e quella laterale vengono solitamente conservate. Comunque si tratta di una patologia fortemente invalidante, che può avere anche gravi ripercussioni sul piano psicologico.
CAUSE
L’eziologia dell’AMD non è stata tuttora dimostrata, ma sono stati evidenziati numerosi fattori di rischio associati alla sua comparsa, quali:
- età superiore ai 55 anni;
- sesso (le donne sono maggiormente predisposte a sviluppare la malattia);
- fumo di sigaretta;
- abuso di alcol;
- diabete mellito;
- vita sedentaria;
- dieta povera di vitamine e acidi grassi (in particolare omega-3);
- ipertensione arteriosa;
- disturbi della coagulazione;
- esposizione prolungata e ripetuta a sorgenti di luce molto intense.
Inoltre è ormai acclarata la familiarità come principale fattore di rischio nello sviluppo della malattia da parte di soggetti con parenti di primo grado che ne sono affetti (l’origine è infatti genetica). [1]
Numerosi sono i fattori genetici che sono stati associati a un incremento del rischio di sviluppare la maculopatia. Tra questi vi sono soprattutto i geni CFH e ARMS2: in particolare la variante del gene CFH (chiamata rs1061170) è stata associata a un aumento di almeno cinque volte del rischio di ammalarsi di AMD.
Tra l’altro è possibile effettuare un test genetico mediante tampone orale per conoscere il rischio di ammalarsi di AMD, ma la sua affidabilità non è ancora molto alta [2]. Uno studio pubblicato a novembre del 2012 individua, inoltre, un meccanismo genetico che, provocando l’aumento dell’espressione di una proteina nella retina (IL17RC), promuoverebbe l’infiammazione della macula e l’attacco, da parte di cellule del proprio sistema immunitario, delle sue stesse cellule (che di conseguenza muoiono).
CLASSIFICAZIONE
Esistono due forme di degenerazione maculare legata all’età (detta anche degenerazione maculare senile), entrambe associate ad alterazioni del microcircolo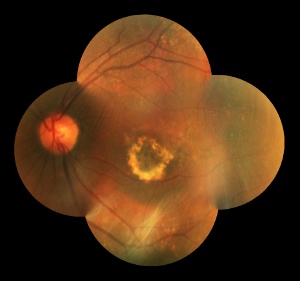

La forma secca o atrofica (85-90% dei casi) è caratterizzata da un assottigliamento progressivo della retina centrale, che risulta scarsamente nutrita dai capillari (poco efficienti) e, di conseguenza, si atrofizza (muoiono le cellule nervose fotosensibili), determinando la formazione di una cicatrice in sede maculare con un aspetto detto a “carta geografica” (areolare).
L’altra forma di degenerazione maculare, quella più grave e a più rapida evoluzione, è detta umida o essudativa (10-15% dei casi): è complicata dalla formazione di nuovi capillari con una parete molto fragile. Questi vasi sono permeabili al plasma (la parte liquida del sangue) e possono dare origine, quindi, a distacchi sierosi dell’epitelio pigmentato retinico e, nei casi più avanzati, si possono rompere facilmente, provocando un’emorragia retinica. I ripetuti episodi emorragici e di riparazione tissutale sono responsabili della formazione di una cicatrice centrale più o meno esuberante.
Entrambe le forme di degenerazione maculare si accompagnano, a livello maculare, alle drusen, ossia a corpi colloidi: si tratta di depositi di “scarto” di forma irregolarmente rotondeggiante, situati sotto la retina (depositi subepiteliali piccoli e polimorfi). Se ne possono distinguere essenzialmente due tipi: hard drusen (meno gravi) e soft drusen (potenzialmente più nocive per la vista). 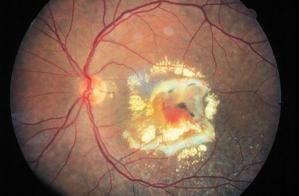

La cosiddetta fase delle drusen è generalmente priva di sintomi e solitamente non dà origine a riduzione dell’acutezza visiva. A volte si può presentare tuttavia una distorsione centrale delle immagini, principalmente delle linee rette (metamorfopsie).
Secondo uno studio pubblicato su Jama Ophthalmology il 2 aprile 2015, l’età senile e la mutazione di due alleli (CFH e ARMS2) sono i due principali fattori di rischio associati allo sviluppo di accumuli proteici:
La copresenza di drusen medie e di anomalie nell’epitelio pigmentato retinico è segno di un rischio maggiore di progressione dell’AMD avanzata rispetto alla sola presenza delle drusen di medie dimensioni.
DIAGNOSI
La diagnosi di degenerazione maculare può essere fatta dall’oculista a seguito di una visita completa. In particolare lo specialista dovrà: raccogliere l’anamnesi del paziente (in modo da rilevare la presenza di eventuale familiarità per la malattia e risalire all’epoca d’insorgenza dei primi disturbi visivi); misurare l’acuità visiva (sia da lontano che da vicino); eseguire l’esame del fondo oculare, che consiste nell’osservare la retina centrale (macula) e quella periferica, tramite l’utilizzo di uno strumento detto oftalmoscopio e apposite lenti (dopo aver dilatato le pupille). Oftalmoscopicamente le drusen appaiono come piccoli depositi di colore giallastro.
Un esame molto facile da eseguire ed utilissimo per monitorare nel tempo l’evoluzione della patologia è il reticolo di Amsler (una griglia a quadretti con un punto centrale), che consente di riconoscere distorsioni o zone cieche centrali. Uno dei sintomi della malattia è, infatti, una distorsione delle linee rette (righe di un quaderno, linee formate dalle mattonelle del pavimento) in prossimità del centro del campo visivo. In presenza di tali alterazioni visive, è importante sottoporsi al più presto ad un controllo medico oculistico per una diagnosi precisa.
In alcuni casi, per meglio inquadrare la situazione clinica, l’oculista può richiedere anche degli esami diagnostici strumentali, quali: l’OCT (tomografia a coerenza ottica),, l’angio-OCT, l’angiografia con fluoresceina (FAG) e l’angiografia al verde di indocianina (ICG). L’OCT permette di studiare le alterazioni ultrastrutturali retiniche nelle fasi precoci della malattia, visualizzando e misurando lo spessore della retina e dei singoli strati retinici; l’angio-OCT ,consente di studiare i vasi retinici senza utilizzare il mezzo di contrasto; l’angiografia con fluoresceina e quella al verde di indocianina, consentono di ottenere immagini molto dettagliate della circolazione sanguigna, sia della retina che della coroide, dopo aver iniettato in vena un mezzo di contrasto.
Tali indagini sono utili allo specialista per fare la diagnosi e studiare l’evoluzione della malattia nel tempo, oltre a essere una guida preziosa per un eventuale trattamento.
Trattamenti
A seconda che si tratti della forma secca oppure di quella umida l’approccio è differente. Le forme secche sono considerate ancora oggi incurabili; tuttavia potrebbe essere possibile, una volta diagnosticata, rallentarne almeno in parte l’evoluzione (ad esempio mediante un corretto stile di vita che va da esercizi fisici regolari a una dieta variata), anche se la questione resta scientificamente controversa. Inoltre esistono alcuni casi in cui le forme secche evolvono in quelle umide.
Alcuni ricorrono a integratori alimentari a base di sostanze antiossidanti, che potrebbero aiutare a combattere la formazione dei radicali liberi e l’ischemia del tessuto retinico maculare (ossia la sua morte dovuta alla riduzione o all’arresto dell’apporto di sangue alla retina). Quelli più comunemente utilizzati sono la luteina, le vitamine A ed E, i sali minerali (quali lo zinco, il rame e il selenio) e gli antiossidanti vegetali (quali la zeaxantina e l’astaxantina). Tuttavia la loro possibile efficacia è stata ridimensionata dallo studio AREDS2.
La terapia fotodinamica (PDT)
La forma umida (essudativa) è stata trattata, soprattutto in passato (oggi si predilige l’uso delle iniezioni intravitreali con farmaci anti-vegf), con la terapia fotodinamica, attuata mediante un tipo particolare di laser, previa iniezione endovenosa di una sostanza chiamata verteporfina. Tale trattamento laser, consente l’occlusione selettiva dei nuovi vasi (crea dei trombi che chiudono i capillari nocivi), cercando di bloccare l’evoluzione della malattia.. Il trattamento può essere ripetuto nel tempo se la malattia dovesse ripresentarsi a distanza di mesi (recidiva).
Le iniezioni intravitreali
Attualmente il trattamento di prima scelta per la maculopatia essudativa è rappresentato dalle iniezioni intravitreali di farmaci anti-VEGF. Si tratta di sostanze che agiscono inibendo la proliferazione di nuovi vasi sanguigni della retina (azione antiangiogenica), che provocano la comparsa di membrane sottoretiniche e di sanguinamenti. Questi farmaci, pegaptanib sodico, bevacizumab[3], ranibizumab [4], aflibercept, e brolucizumab (sono i nomi dei principi attivi), permettono solitamente di ottenere dei buoni risultati nella cura delle degenerazioni maculari essudative, cercando di rallentare/bloccare la malattia e mirando ad ottenere una stabilizzazione del visus del paziente.
La loro somministrazione deve essere effettuata in ambiente sterile e affinché il trattamento possa essere efficace va ripetuto per alcuni mesi. Se, invece, non dovessero esserci benefici o le corrette indicazioni, ovviamente la somministrazione delle iniezioni dovrà essere sospesa.
Ricerche scientifiche relative ai primi farmaci anti-VEGF utilizzati per la maculopatia essudativa
In concomitanza all’utilizzo dei primi farmaci anti-vegf somministrati per via intravitreale, sono state condotte una serie di ricerche scientifiche per verificarne l’efficacia e la sicurezza. In particolare, una ricerca pubblicata sul New England Journal of Medicine [5] nel 2011, è giunta alla conclusione che, a distanza di un anno dall’inizio del trattamento con iniezioni intravitreali, le due molecole generalmente utilizzate (soprattutto all’inizio) contro l’AMD umida (bevacizumab e ranibizumab) avevano i medesimi effetti sull’acuità visiva. “Test clinici – puntualizzano i ricercatori dello studio chiamato CATT (Comparison of Age-related Macular Degeneration Treatments Trials) – hanno stabilito l’efficacia del ranibizumab per il trattamento della degenerazione maculare legata all’età (AMD) neovascolare. Inoltre il bevacizumab viene usato off-label (ossia esulando dalle indicazioni del foglietto illustrativo, ndr) per trattare l’AMD, nonostante l’assenza di analoghi dati a supporto”. In Italia può essere utilizzato come off-label ossia andando oltre le indicazioni contenute nel foglietto illustrativo stesso.
Durante lo studio citato, condotto su 1208 pazienti affetti da AMD neovascolare, “sono state somministrate iniezioni intravitreali di ranibizumab o di bevacizumab in base a una cadenza mensile oppure al bisogno con valutazione mensile. Il risultato primario è stato un cambiamento medio nell’acuità visiva a un anno, con un limite non inferiore di 5 lettere [guadagnate] sull’ottotipo”. Come risultati – prosegue il New England Journal of Medicine – bevacizumab somministrato mensilmente è stato equivalente al ranibizumab somministrato mensilmente, rispettivamente con 8,0 e 8,5 lettere guadagnate“. Inoltre, proseguono i ricercatori, “la diminuzione media dello spessore retinico centrale è stata maggiore nel gruppo del ranibizumab mensile (196 µm) rispetto agli altri gruppi (da 152 a 168 µm)”. In conclusione, si legge ancora sulla prestigiosa pubblicazione britannica, “ad un anno il bevacizumab e il ranibizumab hanno avuto effetti equivalenti sull’acuità visiva quando somministrati secondo lo stesso protocollo. Il ranibizumab somministrato al bisogno, con una valutazione mensile, ha avuto effetti sulla visione equivalenti a quelli del ranibizumab somministrato mensilmente”. Tuttavia, conclude il CATT, “le differenze nell’incidenza di seri effetti collaterali richiedono ulteriori studi”.
Il 2 maggio 2012 la rivista Ophthalmology (rivista dell’Accademia Americana di Oftalmologia) ha pubblicato on-line uno studio (a firma degli stessi ricercatori del CATT) in cui si concludeva quanto segue: “In un periodo di due anni il ranibizumab e il bevacizumab hanno effetti simili sull’acuità visiva”. Lo studio – multicentrico (condotto in diverse università americane e presso il National Eye Institute statunitense) e randomizzato (ossia il trattamento è stato scelto casualmente) – è stato condotto su 1107 pazienti affetti da degenerazione maculare correlata all’età di tipo neovascolare. Anche l’American Academy of Ophthalmology ha dato risalto alla notizia nel proprio sito ufficiale, specificando tra l’altro che “nello studio biennale i tassi di gravi eventi come l’ictus, l’infarto e il decesso sono stati simili in chi ha ricevuto uno dei due farmaci”. Come avvenuto il primo anno – scrive ancora l’AAO – anche nel secondo si è manifestata una percentuale più alta di effetti collaterali non specifici gravi nei pazienti a cui veniva somministrato bevacizumab (40%) rispetto a quelli trattati con ranibizumab (32%). “I ricercatori, osserva ancora l’American Academy of Ophthalmology, sostengono che l’importanza degli effetti collaterali non è chiara; tuttavia potrebbe essere correlata al fatto che l’età media dei pazienti del CATT era di 80 anni, una fascia della popolazione in cui le malattie croniche o acute sono più comuni e ci si attende un tasso di ospedalizzazione più elevato”.
In un altro studio pubblicato nel 2013 sempre su Ophthalmology i ricercatori scrivono che entrambi i principi attivi (ranibizumab e bevacizumab) “sono trattamenti molto efficaci nel preservare l’acuità visiva (VA) nelle persone con degenerazione maculare correlata all’età (AMD)” [6].
Nelle conclusioni di una ricerca pubblicata on-line su Retina il 7 agosto 2014 si legge: “Il bevacizumab e il ranibizumab hanno avuto un’efficacia equivalente sulla migliore acuità visiva corretta nel trattamento della degenerazione maculare legata all’età. Il ranibizumab ha avuto la tendenza a consentire un miglior risultato anatomico. Non ci sono state differenze tra i due farmaci nei tassi di mortalità, di eventi aterotrombotici o di eventi trombotici venosi”; ma saranno necessari ulteriori studi per averne ulteriori conferme [7].
Evoluzione dei farmaci anti-VEGF
Il primo farmaco anti-VEGF ad essere introdotto e approvato dalla Food and Drug Administration (FDA) è stato il Pegaptanib nel 2004. Tuttavia, in relazione alla limitata percentuale di pazienti con un significativo miglioramento dell’acuità visiva, questo trattamento è stato poi superato dall’uso di farmaci più efficaci, quali Ranibizumab, Bevacizumab e Aflibercept. La molecola del Ranibizumab si è dimostrata essere piuttosto efficace in termini di mantenimento dell’acuità visiva del paziente, garantendo inoltre un’elevata sicurezza locale e sistemica. Il Bevacizumab è una molecola più grande, utilizzata comunque per il trattamento della AMD neovascolare come molecola alternativa e più economica rispetto ad altre. Il trattamento con i suddetti farmaci intravitreali prevede un’iniezione al mese per i primi 3 mesi, ed eventuali successive somministrazioni in base alla risposta del paziente.
Una relativamente nuova risorsa è rappresentata dall’Aflibercept, molecola per la quale è suggerito un regime di trattamento con iniezioni intravitreali mensili per i primi tre mesi, seguite da iniezioni ogni 8 settimane.
Sempre nell’ambito dei farmaci anti-VEGF, come nuova cura (ottobre 2019) per il trattamento della AMD neovascolare, è stato approvato da parte della FDA il Brolucizumab. Tale approvazione è poi giunta anche per l’Europa nel 2020. Si tratta di una nuova molecola, che si è dimostrata di pari efficacia rispetto all’Aflibercept, per il cui utilizzo è prevista sempre una somministrazione intravitreale mensile per i primi tre mesi (dose di carico), per poi passare ad un intervallo di trattamento ogni 12 settimane.
Infine, a Settembre 2022 la Commissione europea (CE) ha approvato Faricimab come nuovo farmaco per il trattamento della AMD umida. Il consenso informato della SOI cita: “Il trattamento della degenerazione maculare senile umida con Faricimab prevede iniezioni intravitreali ripetute a distanza di un mese per i primi 4 mesi. Successivamente, sulla base degli esiti anatomici e/o visivi a giudizio del medico oculista tra 20 e 24 settimane dopo l’inizio del trattamento, si raccomanda una valutazione dell’attività della malattia in modo da potere personalizzare la terapia. Nei pazienti senza attività di malattia, deve essere considerata la possibilità di somministrare faricimab ogni 16 settimane (4 mesi). Nei pazienti con attività di malattia, deve essere considerato il trattamento ogni 8 settimane (2 mesi) o 12 settimane (3 mesi). Esistono dati di sicurezza limitati per intervalli tra le iniezioni pari o inferiori a 8 settimane”.
Prospettive future di trattamento dell’AMD
Una delle possibili prospettive future della terapia potrà essere basata su studi a carattere genetico. Inoltre, molto promettente è l’impiego di cellule staminali (in particolare quelle adulte riprogrammate), con cui negli anni a venire si potrà probabilmente rigenerare la retina. Risultati incoraggianti sono stati ottenuti, ad esempio, nel caso dell’AMD secca negli USA (approfondisci).
Altri gruppi di ricerca si stanno concentrando sugli accumuli proteici dannosi per la retina (drusen), cercando di rendere più efficiente la loro rimozione (autofagia). Tali meccanismi, tuttavia, necessitano di ulteriori studi.Bisogna però considerare che, essendo l’AMD una malattia retinica dovuta a diversi fattori, una cura risolutiva (specialmente per la forma secca) non è facile da mettere a punto.
In ambito riabilitativo, si sta utilizzando con un certo successo la tecnica del biofeedback, che consiste nella fotostimolazione neuronale dei recettori retinici attraverso degli spot di luce ad una particolare frequenza, emessi da dispositivi dedicati. Il biofeedback, viene effettuato nella riabilitazione dei pazienti con maculopatia in modo da aumentare la stabilità della fissazione e potenziare l’acutezza visiva. Utili anche gli ausili per gli ipovedenti quali i videoingranditori (disponibili oggi in molti centri ospedalieri). E’ importante diagnosticare precocemente i primi sintomi della degenerazione maculare legata all’età, in modo da attuare le misure preventive più idonee. Tuttavia i pazienti devono comprendere che si tratta di una patologia degenerativa e che, come tale, può lentamente aggravarsi nel tempo; talvolta tutte le terapie effettuate potrebbero non essere sufficienti e, quindi, è il caso di non avere aspettative eccessive.
UN CORRETTO STILE DI VITA: ALIMENTAZIONE VARIA, NIENTE FUMO E PIU’ ESERCIZIO FISICO


Eliminare il fumo è la prima buona pratica di vita. Inoltre controlli accurati del sistema cardiovascolare sono assolutamente raccomandabili. È stato stimato che in chi fuma il rischio di essere colpiti da AMD aumenta fino a tre volte. [14]
Non va assolutamente trascurato l’esercizio fisico moderato, importante ad ogni età. Numerosi studi hanno ipotizzato, infatti, che per chi lo pratica regolarmente sia più difficile essere colpiti dalla degenerazione maculare legata all’età o, se questo avviene, la sua evoluzione è generalmente più lenta. Infine, non bisogna assolutamente trascurare il fatto che i raggi ultravioletti possano contribuire a danneggiare la macula: specialmente se si sono avuti altri casi di AMD in famiglia, bisogna prestare più attenzione al corretto uso di occhiali scuri con lenti a norma di legge (vedi consigli utili). Uno dei principali fattori di rischio potrebbe proprio essere l’esposizione prolungata e cumulativa ai raggi ultravioletti, oltre naturalmente all’età, dunque può essere importante far uso di filtri di buona qualità.
Carta dei diritti del paziente colpito da maculopatia.
[1] Nei familiari di primo grado malati di AMD il rischio di svilupparla è superiore, rispetto alla popolazione generale, dalle 3 alle 6 volte. Esistono indicativamente cinque categorie di geni coinvolti: quelli che controllano l’infiammazione e la risposta cellulare, il metabolismo e il trasporto
dei lipidi, la matrice extracellulare e l’adesione cellulare, l’angiogenesi e la risposta allo stress cellulare.
[2] è stimata attorno al 75%
[3] L’Avastin, originariamente sintetizzato come principio attivo di un trattamento antitumorale (contro il cancro del colon retto), è stato poi impiegato anche per altri scopi, compresi quelli oftalmici, vista la sua proprietà di inibire la proliferazione incontrollata dei vasi retinici dannosi. Viene utilizzato esclusivamente a scopi di ricerca; ad uso oftalmico è impiegato in Italia solo come off-label, ossia esulando delle indicazioni terapeutiche riportate nel foglietto illustrativo.
[4] nome commerciale Lucentis
[5] “Ranibizumab and Bevacizumab for Neovascular Age-Related Macular Degeneration”, The CATT Research Group, N Engl J Med. 2011 Apr 28., e-pub. Lo studio è stato finanziato dal National Eye Institute (ClinicalTrials.gov number, NCT00593450).
[6] Glenn J. Jaffe, Daniel F. Martin, Cynthia A. Toth, Ebenezer Daniel, Maureen G. Maguire, Gui-Shuang Ying, Juan E. Grunwald, Jiayan Huang, “Macular Morphology and Visual Acuity in the Comparison of Age-related Macular Degeneration Treatments Trials”, Comparison of Age-related Macular Degeneration Treatments Trials Research Group, Ophthalmology– September 2013 (Vol. 120, Issue 9, Pages 1860-1870, DOI: 10.1016/j.ophtha.2013.01.073)
[7] Chen G, Li W, Tzekov R, Jiang F, Mao S, Tong Y, “Bevacizumab versus ranibizumab for neovascular age-related macular degeneration: a meta-analysis of randomized controlled trials”, Retina, 2014 Aug 7 (Epub ahead of print)
[8] Si veda ad esempio: Evans JR et al, “28,000 cases of age related macular degeneration causing visual loss in people aged 75 years and above in the UK may be attributable to smoking”, British Journal of Ophthalmology (2005)
Scheda informativa a cura dell’Agenzia internazionale per la prevenzione della cecità-IAPB Italia onlus
Leggi le condizioni generali di consultazione di questo sito
Pagina pubblicata il 31 luglio 2007. Ultimo aggiornamento: 14/02/2023
Ultima revisione scientifica: 14/02/2023







Scrivi nel Forum: un medico oculista ti risponderà gratuitamente.