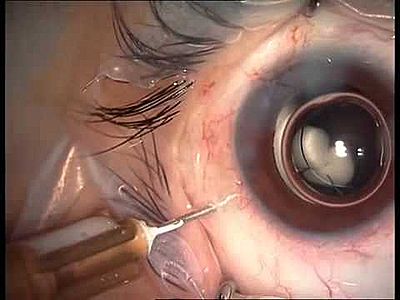
 Nuova decisione Aifa su farmaco AMD umida L’Agenzia italiana del farmaco: le iniezioni intravitreali di Avastin entrano nella lista dei farmaci di uso consolidato per la forma più aggressiva di degenerazione maculare legata all’età 11 giugno 2014 – Il trattamento della forma più aggressiva di degenerazione maculare legata all’età ( AMD umida o essudativa) potrebbe pesare meno sulle casse del Servizio Sanitario Nazionale (SSN). La Commissione tecnico scientifica dell’Agenzia italiana del farmaco ( Aifa ) si è espressa, infatti, a favore dell’inserimento di bevacizumab (Avastin) nell’elenco dei farmaci erogabili a totale carico del Servizio Sanitario Nazionale (SSN). Tuttavia solo le farmacie ospedaliere potranno preparare il farmaco in singole dosi (per garantirne la sterilità) e le iniezioni intravitreali potranno essere effettuate unicamente in centri oculistici specializzati. Si tratta di iniezioni praticate nel bulbo oculare contenenti un principio attivo che può rallentare fortemente la formazione di vasi sanguigni dannosi per la retina, che possono causare cecità centrale. La Commissione tecnico scientifica, scrive l’Aifa, nella seduta del 9 e 10 giugno “ha accolto la richiesta per l’utilizzo del farmaco nell’indicazione non registrata, individuando all’unanimità una serie di condizioni indispensabili a tutela della salute dei pazienti:
Nuova decisione Aifa su farmaco AMD umida L’Agenzia italiana del farmaco: le iniezioni intravitreali di Avastin entrano nella lista dei farmaci di uso consolidato per la forma più aggressiva di degenerazione maculare legata all’età 11 giugno 2014 – Il trattamento della forma più aggressiva di degenerazione maculare legata all’età ( AMD umida o essudativa) potrebbe pesare meno sulle casse del Servizio Sanitario Nazionale (SSN). La Commissione tecnico scientifica dell’Agenzia italiana del farmaco ( Aifa ) si è espressa, infatti, a favore dell’inserimento di bevacizumab (Avastin) nell’elenco dei farmaci erogabili a totale carico del Servizio Sanitario Nazionale (SSN). Tuttavia solo le farmacie ospedaliere potranno preparare il farmaco in singole dosi (per garantirne la sterilità) e le iniezioni intravitreali potranno essere effettuate unicamente in centri oculistici specializzati. Si tratta di iniezioni praticate nel bulbo oculare contenenti un principio attivo che può rallentare fortemente la formazione di vasi sanguigni dannosi per la retina, che possono causare cecità centrale. La Commissione tecnico scientifica, scrive l’Aifa, nella seduta del 9 e 10 giugno “ha accolto la richiesta per l’utilizzo del farmaco nell’indicazione non registrata, individuando all’unanimità una serie di condizioni indispensabili a tutela della salute dei pazienti: -il confezionamento in monodose del farmaco bevacizumab per l’uso intravitreale dovrà essere effettuato, per garantirne la sterilità, esclusivamente dalle farmacie ospedaliere in possesso dei requisiti necessari, nel rispetto delle Norme di Buona Preparazione; -la somministrazione di bevacizumab per uso intravitreale dovrà essere riservata a centri oculistici ad alta specializzazione presso ospedali pubblici individuati dalle Regioni; -la somministrazione del farmaco – puntualizza l’Aifa – potrà avvenire solo previa sottoscrizione da parte del paziente del consenso informato, che contenga le motivazioni scientifiche accompagnate da adeguate informazioni sull’esistenza di alternative terapeutiche approvate, seppure ad un costo più elevato a carico del SSN; -l’attivazione di un registro di monitoraggio a cui sia allegata la scheda di segnalazione delle reazioni avverse”. La stessa Commissione tecnico scientifica, tuttavia, introduce una riserva: quella di poter fare in futuro una diversa valutazione in seguito dell’analisi dei dati raccolti direttamente o di ogni ulteriore evidenza scientifica. “Con riferimento alla decisione di Aifa volta ad implementare la nuova legge sull’impiego di farmaci off label, Novartis – commenta la multinazionale farmaceutica – esprime la sua forte preoccupazione in merito alla rimborsabilità a carico del Servizio Sanitario Nazionale – seppur limitata a specifici centri di riferimento – dell’utilizzo off label di Avastin come alternativa al farmaco approvato Lucentis per il trattamento dei pazienti affetti da patologie oftalmiche”. Note ai sensi della legge 648/96 Il suo parere, scrive l’Aifa, “è stato espresso alla luce delle richieste avanzate dalle Regioni Veneto ed Emilia Romagna per l’inserimento di bevacizumab nella lista della legge 648/96 (lista classica) per la degenerazione maculare legata all’età, visto il parere del Consiglio Superiore di Sanità (CSS) in merito al profilo di sicurezza e di efficacia dei farmaci Avastin e Lucentis (sezione V seduta del 15 aprile 2014) e la nuova regolamentazione sull’uso off-label dei farmaci (DL 20 marzo 2014 convertito in Legge n. 79 del 16 maggio 2014)”.
-il confezionamento in monodose del farmaco bevacizumab per l’uso intravitreale dovrà essere effettuato, per garantirne la sterilità, esclusivamente dalle farmacie ospedaliere in possesso dei requisiti necessari, nel rispetto delle Norme di Buona Preparazione; -la somministrazione di bevacizumab per uso intravitreale dovrà essere riservata a centri oculistici ad alta specializzazione presso ospedali pubblici individuati dalle Regioni; -la somministrazione del farmaco – puntualizza l’Aifa – potrà avvenire solo previa sottoscrizione da parte del paziente del consenso informato, che contenga le motivazioni scientifiche accompagnate da adeguate informazioni sull’esistenza di alternative terapeutiche approvate, seppure ad un costo più elevato a carico del SSN; -l’attivazione di un registro di monitoraggio a cui sia allegata la scheda di segnalazione delle reazioni avverse”. La stessa Commissione tecnico scientifica, tuttavia, introduce una riserva: quella di poter fare in futuro una diversa valutazione in seguito dell’analisi dei dati raccolti direttamente o di ogni ulteriore evidenza scientifica. “Con riferimento alla decisione di Aifa volta ad implementare la nuova legge sull’impiego di farmaci off label, Novartis – commenta la multinazionale farmaceutica – esprime la sua forte preoccupazione in merito alla rimborsabilità a carico del Servizio Sanitario Nazionale – seppur limitata a specifici centri di riferimento – dell’utilizzo off label di Avastin come alternativa al farmaco approvato Lucentis per il trattamento dei pazienti affetti da patologie oftalmiche”. Note ai sensi della legge 648/96 Il suo parere, scrive l’Aifa, “è stato espresso alla luce delle richieste avanzate dalle Regioni Veneto ed Emilia Romagna per l’inserimento di bevacizumab nella lista della legge 648/96 (lista classica) per la degenerazione maculare legata all’età, visto il parere del Consiglio Superiore di Sanità (CSS) in merito al profilo di sicurezza e di efficacia dei farmaci Avastin e Lucentis (sezione V seduta del 15 aprile 2014) e la nuova regolamentazione sull’uso off-label dei farmaci (DL 20 marzo 2014 convertito in Legge n. 79 del 16 maggio 2014)”.

Nuova decisione Aifa su farmaco AMD umida
- 11 Giugno 2014
- 12:00 am
Condividi su facebook
Facebook
Condividi su twitter
Twitter
Condividi su linkedin
LinkedIn

